近日,开云(中国)翟光喜教授、叶磊副研究员在国际期刊ACS Nano(中科院Top一区),杂志上发表了题为“Injectable Zwitterionic Physical Hydrogel with Enhanced Chemodynamic Therapy and Tumor Microenvironment Remodeling Properties forSynergistic Anticancer Therapy”的研究性论文,叶磊副研究员、翟光喜教授,天津大学李俊杰教授为共同通讯作者,开云(中国)硕士研究生方跃霖和黄苏苏为论文共同第一作者,开云在线登录官网为第一作者和通讯作者单位。

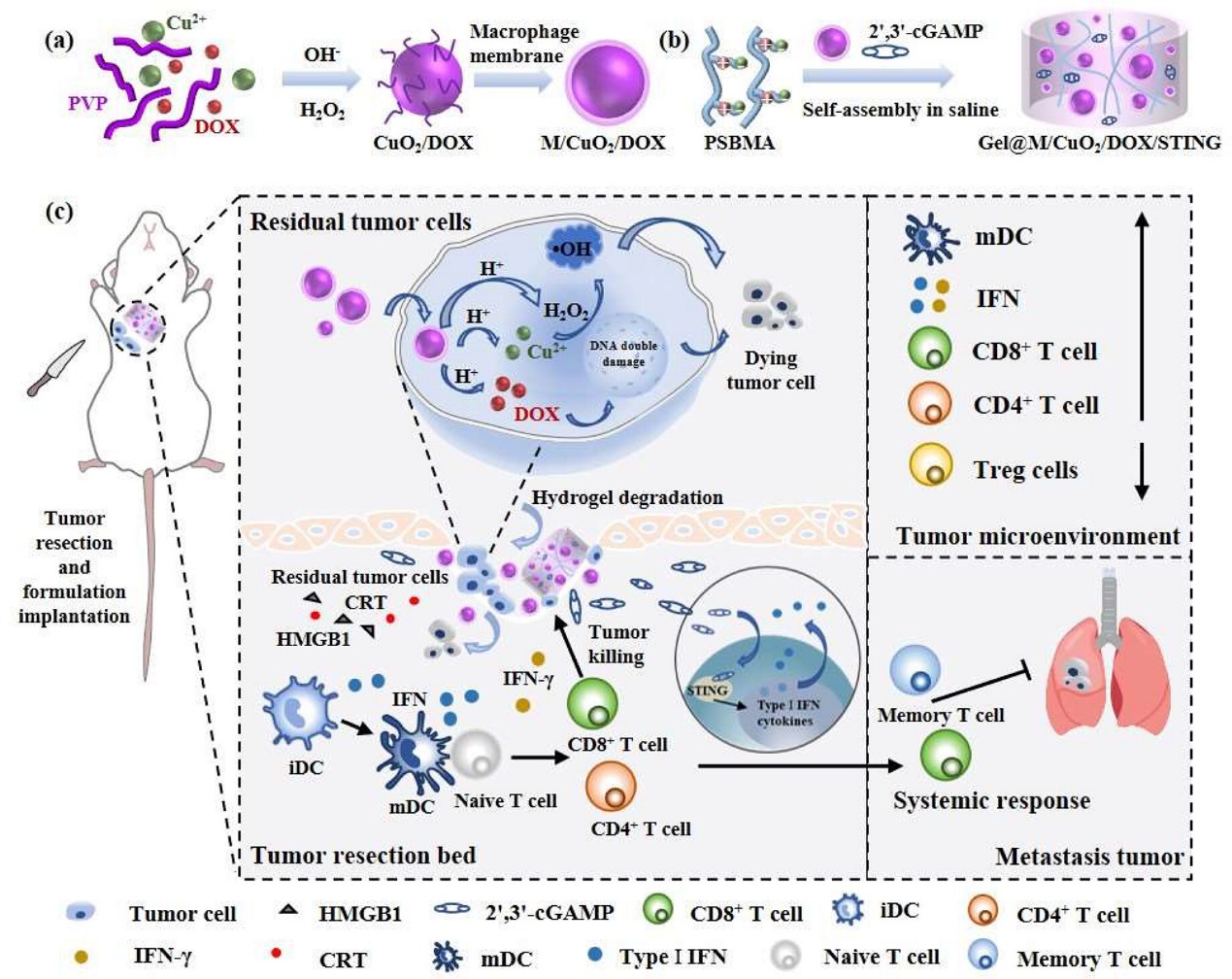
手术切除是乳腺癌的一线治疗方式,但残留的肿瘤细胞和高度免疫抑制的肿瘤微环境(TME)继续对肿瘤复发和转移产生严重影响。目前化学动力学(CDT)的应用已被广泛探索,但基于CDT的治疗效果仍然不理想。芬顿(Fenton)试剂在肿瘤部位的积累有限是其中一个原因,另外,肿瘤细胞内源性H2O2水平不足和强大的抗氧化系统限制了•OH的生成并加速了•OH消耗,从而降低了Fenton和类Fenton反应的效率。本研究中开发了一种可注射两性离子水凝胶系统(Gel@M/CuO2/DOX/STING),用于局部药物递送,以增强免疫激活和预防肿瘤复发。将该水凝胶系统植入荷瘤小鼠手术后的空腔中,TME中的体液可以影响水凝胶骨架的离子相互作用,使水凝胶降解,然后释放出小尺寸的纳米粒子(M/CuO2/DOX)和2',3'-cGAMP,肿瘤细胞摄取纳米颗粒后,肿瘤酸性环境触发M/CuO2/DOX释放阿霉素(DOX)和Fenton催化剂(Cu2+和H2O2)。此外,Cu2+与自供的H2O2反应生成活性氧(ROS)。DOX和CDT的结合显著触发肿瘤细胞死亡,并恢复肿瘤抗原识别。释放的STING激动剂和DOX诱导的DNA损伤,激活STING通路,促进I型干扰素的分泌,将促进树突状细胞DCs的成熟,增强肿瘤特异性T细胞浸润,从而重塑免疫抑制微环境。另外,通过细胞毒性实验、3D培养实验和主要脏器HE染色证实其具有优异的生物相容性。该可注射性水凝胶在体内具有良好的生物可降解性,终降解产物为CO2和H2O;小动物活体成像实验表明该制剂可在病灶部位滞留14天以上,发挥持续抗肿瘤作用。
近年来,翟光喜教授/叶磊副研究员团队在水凝胶材料的合成与应用,抗肿瘤免疫治疗和抗肠粘连等方面取得了一系列重要成果,曾发表于Materials Today Nano, ACS Nano,Journal of Materials Chemistry A, Acta Biomaterialia, Materials & Design等期刊上。该项工作得到了国家自然科学基金、“重大新药创制”国家科技重大专项、山东省自然科学基金、山东省泰山产业领军人才课题的资助。
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.3c05898
