近日,开云(中国)张娜教授、刘永军副教授团队在克服CAF屏障提高胰腺癌治疗效果方面取得新进展,在国际期刊ACS Nano杂志上发表了题为Transforming Cancer-Associated Fibroblast Barrier into Drug Depots to Boost Chemo-Immunotherapy in“Shooting Fish in a Barrel”Pattern的研究性论文(中科院一区TOP,封面文章),张娜和刘永军为通讯作者,博士研究生袁诗俊为第一作者,开云(中国)为第一作者单位和唯一通讯作者单位。
胰腺导管腺癌(PDAC)中的癌相关成纤维细胞(CAF)屏障大大限制了临床结果。CAF屏障通过三个主要机制阻碍了PDAC的治疗效果。首先,由于CAFs优先定位在血管附近,对试图进入肿瘤核心部位的药物和纳米粒子有很强的结合点屏障(Binding site barrier,BSB)作用。第二,CAFs产生大量的胶原蛋白等细胞外基质,促进微环境僵硬,阻碍免疫细胞的浸润。第三,异常激活的CAFs可以分泌免疫抑制性细胞因子,以抑制免疫细胞活性,支持免疫抑制性微环境的产生。
针对以上关键科学问题,本文设计了一种“瓮中捉鳖”(Shooting Fish in a Barrel)的策略。通过制备脂质-聚合物杂合纳米系统(PI/JGC/L-A),将围绕肿瘤分布的CAFs改造成抗肿瘤药物的储库,使其能够持向深层肿瘤部位续分泌免疫调节剂IL-12和化疗药物Gemcitabine,这既克服了药物递送和免疫细胞浸润的屏障也实现了肿瘤深层的化学免疫联合治疗,极大地提高了抗肿瘤效果。
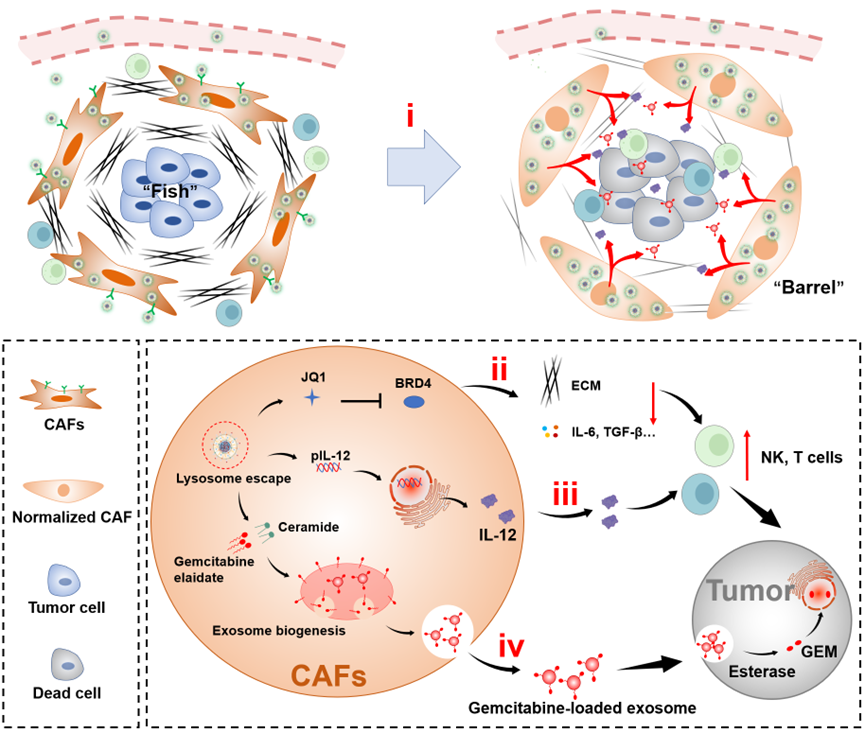
图1.PI/JGC/L-A实现跨CAF屏障药物递送,增加肿瘤部位的免疫细胞浸润,并以"瓮中捉鳖"的模式促进胰腺癌化疗-免疫治疗效果的示意图
综上,本策略是克服药物输送屏障的有效方法,它可能适用于面临递送屏障的肿瘤模型,包括但不限于PDAC。
近年来,张娜、刘永军团队在肿瘤免疫联合治疗方向取得了一系列研究成果,先后开发了肿瘤-淋巴结微环境免疫调节纳米诱导剂(Nat. Commun. 2023, 14, 2248)化疗-光热治疗集成纳米递送平台(Adv. Funct. Mater. 2021, 2100437),集成纳米航空母舰(Adv. Funct. Mater. 2021, 31, 2106123),重塑肿瘤免疫微环境的纳米笼(ACS Nano 2022, 16, 3, 4263–4277),双转换原位自组装疫苗(Chemical Engineering Journal 2023,454,140190),基于启动反应-促进活性-缓解抑制的自体肿瘤疫苗(Biomaterials 2023,297,122104)等新型药物递送系统。上述研究工作得到了国家自然科学基金、山东省重点研发项目和山东大学青年学者未来计划项目的大力支持。
论文链接:https://pubs.acs.org/doi/10.1021/acsnano.3c02272
